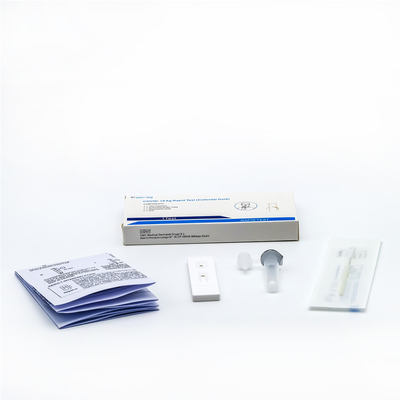
Descripción de producto: Equipo rápido de la detección del antígeno del CE, equipo plástico de la prueba del antígeno
El equipo rápido de la prueba del antígeno es más rápido y menos intruso que una prueba de la reacción en cadena de polimerasa (polimerización en cadena). Este makess él fácil para que el público utilice para probarse si es necesario. En general, el niño rápido de la prueba del antígeno tiene una sensibilidad (capacidad de una prueba de identificar a pacientes con la enfermedad) del cerca de 95% para los casos con cargas virales más altas y una gama de la especificidad (capacidad de una prueba de identificar a pacientes sin la enfermedad) de 99.1%.As la sensibilidad y la especificidad del antígeno el equipo rápido de la prueba es más bajo con respecto a pruebas de la polimerización en cadena, si usted prueba el equipo rápido de la prueba del antígeno positivo o inválido dos veces, que usted necesitará seguir con una prueba confirmativa de la polimerización en cadena. Usted no debe repetir el equipo rápido de la prueba del antígeno incluso si usted prueba negativo en la prueba repetida, él puede ser un resultado del falso negativo y por lo tanto usted necesita ir para una prueba confirmativa de la polimerización en cadena. Los equipos rápidos de la prueba del antígeno de Poweray tienen buen funcionamiento y con alta sensibilidad para detectar el antígeno en el primero tiempo de la infección. Prueba rápida del alto rendimiento permitir medidas inmediatas del tratamiento o del aislamiento para minimizar la transmisión
Componentes principales: El equipo consiste en tarjetas de la prueba, el almacenador intermediario de la muestra, y la ESPONJA.
Tarjeta de la prueba: integrado por bolso del papel de aluminio, el desecante, la tira de prueba y la tarjeta plástica. La hoja de prueba consiste en el papel absorbente, la película de la nitrocelulosa, el cojín de la prueba, el cojín adhesivo y la hoja de goma. línea de t que cubre la película de la nitrocelulosa con el nvvab 2019 (línea de la prueba), c con el cabra-ratón ab policlonal (línea de la gestión de calidad) y el nvvab 2019. en el cojín
Almacenador intermediario de la muestra: fosfato, nitruro del sodio, etc.
Uso del producto:
Este equipo se utiliza para la detección cualitativa de vitro del coronavirus (Covid-19) en las secreciones faríngeas o nasales humanas, muestras del sailva.
Utilizado como indicador suplementario de la prueba para los casos sospechosos de la negativa nucléica de la prueba ácida del nuevo coronavirus o utilizado conjuntamente con la prueba ácida nucléica en la diagnosis de casos sospechosos
Precauciones:
1. Este producto se utiliza para la diagnosis in vitro solamente.
2. Este producto está disponible y no puede ser reciclado.
3. lea las instrucciones cuidadosamente antes de la operación 3. y siga estrictamente las instrucciones el reactivo.
4. Evite las condiciones ambientales severas incluyendo el desinfectante 84, hipoclorito de sodio, ácido y el álcali o el acetaldehído, otras altas concentraciones de gases y de polvo corrosivos, el etc., el laboratorio disinfed
5. Todas las muestras y reactivo usados serán considerados como materiales potencialmente infecciosos y tratados de acuerdo con la legislación local.
6. Los reactivo del uso dentro del período de la validez indicaron en el paquete externo. Utilice la tarjeta de la prueba cuanto antes después de retiro del bolso del papel de aluminio.
Procedimiento de la inspección:
- Quite la hoja desde arriba del tubo del almacenador intermediario de la extracción
- Abra el paquete de la esponja en el extremo del palillo
- Inserte suavemente la esponja en la ventana de la nariz y la extremidad de la esponja se debe insertar la pulgada 1/2-3/4 lejos del borde de la ventana de la nariz
- Ruede la esponja a lo largo de la membrana mucosa dentro de la ventana de la nariz 5 veces, tardando cerca de 15 segundos para recoger el espécimen
- Inserte la esponja de muestreo en el almacenador intermediario de la muestra
- Remolina el tubo por 30 segundos
- Gire la esponja 5 veces mientras que exprime el tubo
- Quite la esponja mientras que exprime el tubo
- Cubra el emisor
- Añada 2 descensos para extraer la muestra tratada al pozo cargado de la tarjeta de la prueba y después para comenzar el contador de tiempo
- Licencia en la temperatura ambiente por 15 minutos antes de leer los resultados. El resultado será inválido después de 20 minutos
Explicación detallada de los resultados de la prueba:

Limitación del método de prueba:
1. Este producto se utiliza para la prueba cualitativa y solamente para la diagnosis ayudada in vitro.
el producto 2.This solicita muestras de la nariz. El otro tipo resultados de la muestra puede ser inexacto o inválido.
3. añade apropiadamente las muestras para probar. El tamaño de muestra demasiado grande o demasiado pequeño puede llevar a los resultados inexactos.
4.It no debe ser la única base para los ensayos clínicos y el tratamiento. La diagnosis final se puede hacer después de una evaluación completa de todos los resultados clínicos y experimentales.
Si cualquier pregunta, tolerancia del contacto de los pls por el correo electrónico: grace@poweray.com.cn, móvil/wechat: 13310839332

 ¡Su mensaje debe tener entre 20 y 3.000 caracteres!
¡Su mensaje debe tener entre 20 y 3.000 caracteres! ¡Por favor revise su correo electrónico!
¡Por favor revise su correo electrónico!  ¡Su mensaje debe tener entre 20 y 3.000 caracteres!
¡Su mensaje debe tener entre 20 y 3.000 caracteres! ¡Por favor revise su correo electrónico!
¡Por favor revise su correo electrónico!